ARTROSCOPIA | VOL. 10, Nº 1 : 51-54 | 2003
Técnica de cultivo de condrocitos autólogos
Lic. Licia Battaglia, Dra. Graciela Lucero, Dr. Martín Morhac, Dr. Benjamín Koziner
RESUMEN:
Dado el limitado potencial regenerativo del cartílago articular, el acceso a material cuya estructura, composición, propiedades mecánicas y durabilidad sean similares al tejido original, ha incentivado el desarrollo de métodos de cultivo de condrocitos autólogos. En este trabajo se describe la técnica de cultivo que es utilizada en nuestro laboratorio para el aislamiento, expansión y caracterización de condrocitos autólogos a partir de una biopsia de cartílago articular.
Cabe anticipar que en el futuro el procedimiento podrá ser optimizado, sobre todo por la adición de factores de crecimiento y/u otras moléculas, con la finalidad de producir material tisular en cantidad y calidad suficiente para reparar defectos del cartílago autólogo.
ABSTRACT:
Due to the limited regenerative potential of articular cartilage, the access to material similar in structure, composition, mechanical properties and durability to the original tissue has stimulated the development of culture methods of autologous chondrocytes. In this review, we describe the culture technique used in our laboratory for the isolation, expansion and characterization of autologous chondrocytes obtained from an arthroscopic biopsy of the articular cartilage, to be used in the repair of cartilage lesions of the knee.
It should be mentioned that this procedure could be optimized in the future, mostly by the addition of growth factors and other molecules with the purpose of producing tissue material in sufficient quantity and quality to repair autologous cartilage.
INTRODUCCION
El cartílago articular es un tejido altamente especializado de la articulación, con una limitada capacidad regenerativa debido a la ausencia de vasos sanguíneos y al bajo potencial mitogénico de los condrocitos.
La discapacidad y el dolor que resultan del daño del cartílago articular han estimulado la investigación de procedimientos reparativos que provean un tejido con estructura, composición, propiedades mecánicas y durabilidad similares a la superficie articular normal.
Las opciones quirúrgicas para tratar al cartílago dañado incluyen: debridamiento y lavaje, perforación del hueso subcondral, microfractura, artroplastía por abrasión y osteotomía tibial proximal (1,5,6,9,10,11,16).
Cada uno de estos procedimientos puede ayudar a aliviar los síntomas clínicos de dolor e inmovilidad, pero ninguno resulta en la restauración fisiológica del cartílago articular. El tejido de reparación formado a partir de estos procedimientos es fibrocartílago, que carece de las propiedades biomecánicas y bioquímicas del cartílago articular intacto.
El trasplante de injertos periósticos/pericondrales es un reciente avance que tiene la ventaja de poder cubrir grandes áreas de superficie articular, pero el tejido reparado inicialmente tiende a calcificarse y a ser reemplazado por hueso a través de la osificación endocondral (8,12,13,14,15). Se han obtenido resultados similares con la implantación de células stem mesenquimales (2,7,17), células pluripotentes provenientes de la médula ósea que tienen la capacidad de formar muchos tipos de tejidos. En los modelos animales se ha demostrado que el cartílago tipo hialino que se forma también calcifica, generando hueso como resultado.
Los pobres resultados a largo plazo logrados con las modalidades de tratamiento enumeradas indujeron a los investigadores del Hospital for Joint Diseases en Nueva York a desarrollar técnicas de implante de condrocitos autólogos cultivados a principios de la década de los ´80 (3). La evolución de esta investigación continuó en la Universidad y el Hospital Universitario de Sahlgrenska en Goteborg, Suecia, quienes publicaron en octubre de 1994 en el New England Journal of Medicine los resultados favorables de 7 años de experiencia con esta técnica. Información reciente proveniente del mismo grupo de trabajo, publicados en octubre del 2001, confirmó los beneficios a largo plazo de esta técnica. Estos cirujanos reportaron en 213 pacientes con seguimiento de 2 a 10 años: 88% de mejoría para pacientes con lesiones únicas del cóndilo femoral y 74% de mejoría en otro grupo de pacientes con diferente tipo de lesiones. (4).
Hasta el presente, se han registrado más de 6.000 procedimientos de este tipo en numerosos centros en EE. UU. y en Europa, constituyendo una alternativa válida para patologías traumáticas y/o incipientemente degenerativas del cartílago articular.
El objetivo de este trabajo es describir la técnica de cultivo que es utilizada en nuestro laboratorio para el aislamiento, expansión y caracterización de condrocitos autólogos, a partir de una biopsia de cartílago articular, para ser empleado en la reparación de lesiones de cartílago de rodilla no mayores a 10 cm2.
MATERIAL Y METODO
Se realiza en primer lugar una artroscopía para obtener material de cartílago, a partir del cual se aislarán células para iniciar el cultivo.
Se requiere como mínimo 2 cilindros de 4 mm de diámetro, aproximadamente 200 mg, los cuales se sumergen en medio de cultivo de transporte.
La muestra debe arribar al laboratorio dentro de las 48 hs. de realizada la toma, para su posterior procesamiento.
En el clean room y bajo una campana de flujo laminar se extrae el material de la biopsia y se lo transfiere a una caja de Petri. Con la ayuda de pinza y escalpelo se disgrega la muestra de cartílago y se sumerge en una solución de colagenasa, en atmósfera al 5% de CO2 a 37ºC.
Luego de la digestión enzimática, la suspensión celular es filtrada a través de una malla de nylon y se realiza el lavado con medio de cultivo.
Se agrega la cantidad de medio de cultivo adecuada para obtener una suspensión celular que será cultivada inicialmente a 1500-3000 células/cm2 de fras-
co de cultivo a 37ºC en atmósfera al 5% de CO2. Cuando el cultivo llega a confluencia es repicado. Este procedimiento se repite hasta alcanzar el número de células requerido para reparar el defecto (1 x 106 células/cm2 de defecto).
Las células se cosechan un día antes de la cirugía y se las resuspende en 300-500 µl de medio de transporte sin rojo fenol ni suplementos.
En caso de que la cirugía del paciente se postergue, las células son congeladas y conservadas en nitrógeno líquido. Una vez decidida la fecha de la cirugía, las células son descongeladas 7 a 14 días previos a la entrega en las condiciones anteriormente descriptas.
Se realizan controles de calidad de los condrocitos expandidos ex vivo que van a ser reimplantados. Se evalúa la morfología de las células con cultivo en paralelo de líneas de fibroblastos NHDF y condrocitos HCH e inmunomarcación para obtener el perfil de expresión de los marcadores de superficie de las muestras cultivadas.
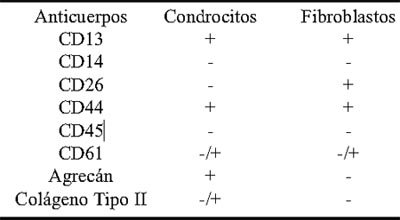
La caracterización inmunofenotípica se realiza empleando un panel de anticuerpos monoclonales con especificidades para condrocitos y fibroblastos, siendo evaluada en un citómetro de flujo.
Los condrocitos expandidos en cultivo, muestran expresión de la molécula de agrecán (Fig. 1) la cual se evidencia mediante el empleo de un anticuerpo monoclonal dirigido contra la región de unión con ácido hialurónico (HABR)(18).
El agrecán, junto con la molécula CD26 (19) son considerados los marcadores más específicos y de mayor utilidad para establecer el perfil fenotípico diferencial con fibroblastos, los cuales a diferencia de los condrocitos muestran positividad al antígeno CD26 y negatividad al agrecán. La caracterización inmunofenotípica incluye también anticuerpos monoclonales para la detección de otros antígenos como CD13 y CD44 (20,21) los cuales si bien no son exclusivos de este tipo celular están normalmente presentes en los condrocitos expandidos.
Los condrocitos muestran muy alta expresión de la molécula CD44, principal receptor del ácido hialurónico, involucrado en las interacciones con la matriz extracelular.
El panel incluye también anticuerpos monoclonales para la exclusión de células hematopoyéticas como CD45 (antígeno común leucocitario) y CD14 (células mieloides y monocitos) (Tabla I).

Figura 1: Análisis por citometría de flujo de condrocitos:
A.Control isotípico conjugado con fluorocromos, usando como control negativo.
B.Anticuerpo anti-agrecán (técnica de fluorescencia indirecta).
Tabla 1: Características inmunofenotípicas de condrocitos y fibroblastos.
DISCUSION
La posibilidad de expandir condrocitos autólogos ex vivo, se ha convertido en un metodo ideal para la reparación de lesiones del cartílago articular. A nivel laboratorial se está trabajando intensamente en la optimización de los protocolos de cultivo, ya sea usando diferentes citoquinas (ej. EGF, bFGF, IGF, PDGF) y hormonas (como insulina y dexametasona), así como también diferentes adherentes como fibronectina, gelatina y colágeno. Esto permitirá la definición de las condiciones ideales de tecnología con su consecuente repercusión en los resultados clínicos.
BIBLIOGRAFIA
- Baumgaertner MR, Cannon WD, Vittori JM et al. Arthroscopic debridement of the arthritic knee. Clinical Orthopaedics Related Res. 1990: 253: 197-202.
- Benya PD, Schaffer JD. Dedifferentiated chrondrocytes reexpress the differentiated collagen phenotype when cultured in agarose gels. Cell. 1982: 30:215-224.
- Brittberg M, Lindhal A, Nilsson A et al. Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation. N Engl J Med 1994:331(14): 889-895.
- Brittberg M, Tallheden T, Sjogren-Jansson B, Lindahl A, Peterson L. Autologous chondrocytes used for articular cartilage repair: an update. Clin Orthop 2001. Oct; (391 Suppl): S337-48.
- Chang RW, Falconer J, Stulberg SD et al. A randomized, control trial of arthroscopic surgery versus closed-needle joint lavage for patients with osteoarthritis of the knee. Arthritis Rheum. 1993: 36 (3): 289-296.
- Coventry MB. Ilstrup DM, Wallrichs SI. Proximal tibial osteotomy. J Bone Joint Surg. 1993: 75A(2):196-201.
- Grande DA, Southerland SS, Manji R. et al. Repair of articular cartilage defects using mesenchymal stem cells. Tiss Eng. 1995: 1(4): 345-353.
- Homminga GN, Bulstra SK, Bouwmeester PSM, Van Der Linden AJ. Perichondrial grafting for cartilage lesions of the knee. J Bone Joint Surg Br. 1990:72B: 1003-1007.
- Jackson RW, Marans HJ, Silver RS. Arthroscopic treatment of degenerative arthritis of the knee. J Bone Joint Surg. 1988: 70B: 332.
- Jackson RW. Arthroscopic treatment of degenerative arthritis. In McGinty JB. ed. Operative Arthroscopy. New York NY: Raven Press: 1991: 319-323.
- Johnson LL. Arthroscopic abrasion arthroplasty. In: McGinti JB. de. Operative Arthroscopy. New York. NY: Raven Press: 1991: 341-360.
- O´Driscoll SW, Keeley FW, Salter RB et al. Durability of regenerated cartilage produced by free autogenous periosteal grafts in major full-thickness defects in joint surfaces under the influence of continuous passive motion. J Bone Joint Surg. 1988: 70A: 595-606.
- Ritsula VA, Santavirts S, Alhopuro S et al. Periosteal and perichondrial grafting in reconstructive surgery. Clin Orthop. 1994: 302: 259-265.
- Rubak JM, Poussa M, Ritsila V. Chondrogenesis in repair of articular cartilage defects by free periosteal grafts in rabbits. Acta Orthop. 1982: 53: 181-186.
- Skoog T, Johansson SH. The formation of articular cartilage from free perichondrial grafts. Plastic Recons Surg. 1976: 57(1): 1-6.
- Tippet JW. Articular cartilage drilling and osteotomy in osteoarthritis of the knee. In: McGinty JB. ed. Operative Arthroscopy. New York. NY: Raven Press:1991: 325-339.
- Wakitani S, Goto T, Pineda SJ et al. Mesenchymal cell-based repair of large, full-thickness defects of articular cartilage. J Bone Joint Surg. 1994: 76A(4):579-592.
- Wang L, Almqvist KF, Broddelez C et al. Evaluation of chondrocyte cell-associated matrix metabolism by flow cytometry. Osteoarthritis Cartilage 2001: 9(5):454-462.
- Dang NH, Torimoto Y, Schlossman SF et al. CD4 helper T-cell activation: functional involvement of two distinct collagen receptors, IF7 and VLA integrin family. J. Exp. Med. 1990: 172: 649.
- Gunthert U. CD44: a multitude of isoforms with diverse functions. Curr. Topics Microbio. Immunol 1993: 184: 47.
- Lesley J, Hyman R, Kincade PW. CD44 and its interaction with extracellular matrix. Adv. Immunol 1993: 54: 271-335.
Dr. BenjamÌn Koziner Laboratorio de Cultivo Celular Cell Prep S.A.
Av. Pte. Quintana 345, PB “A” (1014) Buenos Aires Argentina TEL/FAX (+54-11) 4813-8698
e.mail: Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
