ARTROSCOPIA | VOL. 15, Nº 1 : 31-40 | 2008
Uso de concentrado autologo rico en factores de crecimiento en la reconstrucción del LCA
Dr. Fernando Radice D., Dr. Roberto Yánez D., Dr. Vicente Gutiérrez B., Dr. Miguel Pinedo B., Dr. Julio Rosales, Dr. Sebastián Coda
RESUMEN: Hipótesis: La aplicación de factores de crecimiento obtenidos de concentrado plaquetario autólogo al injerto al efectuar la reconstrucción de ligamento cruzado anterior en deportistas, afecta positivamente el proceso de remodelación del injerto utilizado. Objetivo: Determinar el efecto que tiene en el proceso de remodelación del injerto, la aplicación de factores de crecimiento obtenidos de concentrado plaquetario autólogo al efectuar la reconstrucción de ligamento cruzado anterior en deportistas. Diseño del estudio: Prospectivo, clínico randomizado, con grupo control y ciego simple. Método: Se realiza en forma prospectiva el análisis de 50 reconstrucciones de LCA en 50 pacientes, todas ellas realizadas por el mismo equipo quirúrgico. Al grupo A, además de efectuar la reconstrucción de LCA, se adiciona Concentrado Plaquetario Autólogo, desarrollando una técnica de aplicación que permite estandarizar la dosis de concentrado empleada y evitar la pérdida de este en el paso del injerto a través de los túneles óseos. Los pacientes del grupo A se sometieron a estudio de resonancia magnética en forma seriada a los 3, 4, 5, 6, 7, 8 y 9 meses postoperatorio. El grupo control el estudio se realizó a los 3, 4,6,7, 9,10 ,11 ,12 meses. La evaluación de las placas obtenidas fue realizada por un solo radiólogo en forma ciega, ya que desconocía: tiem- po de evolución, técnica quirúrgica empleada o si se aplicó AGF. Analisis Estadístico: Comparación de Grupos: T-Student (p-value < 5%) y Prueba F (p-value < 5%).Modelo Cuadrático Predictivo de Tiempo de Maduración (Homogeneidad) para determinar el tiempo de remodelación y maduración en cada grupo. Resultados: El puntaje promedio de maduración al momento de la resonancia magnética, entregado por el radiólogo en el grupo A fue de 1,14 y en el grupo B (control) fue de 3,25.Ambos grupos son comparables según sexo y edad (p-value < 5%). El tiempo de maduración del segmento intraarticular, en el grupo A (con adición de AGF) alcanzó los 177 días posterior a la cirugía. En el grupo B (control) fue de 369 días. Esto determina injertos maduros, en el caso de pacientes con factores de crecimiento, en la mitad del tiempo (49,4%) que injertos sin Factores de crecimiento (p-value 0,000). Conclusiones: La aplicación de factores de crecimiento obtenidos de concentrado plaquetario autólogo al injerto al efectuar la reconstrucción de ligamento cruzado anterior en deportistas, afecta positivamente el proceso de remodelación del injerto utilizado acortando el tiempo normal de maduración en un 49.4%
ABSTRACT: Hypothesis: Application on the free tendon auto graft of Platelet Derived Growth Factor on free tendon graft remodeling after anterior cruciate ligament reconstruction in athletes, may affect the remodeling process of the graft. Purpose: To determine the influence of platelet - derived growth factor on tendon graft remodeling in athletes. Study Design: Controlled Randomized prospective clinical study. Methods: The study group (25 knees from 25 patients) underwent anterior cruciate ligament reconstruction. 10 patients with the autogenous bone -patellar tendon -bone graft and 15 with hamstring tendon (semitendinosus and gracilis tendon). During the surgery the graft was prepare using a bio-scaffold with 5 cc of Platelet rich plasma gel (PRPG). The control group (25 knees from 25 patients) under- went ACL reconstruction without PRPG. 21 patients with the autogenous bone -patellar tendon -bone graft and 4 with hamstring tendon. MRI evaluation was done between 2 and 9 months post-op for the study group and 6 to 12 months post-op in the control group. Statistical Analysis: Both groups were comparable in the sex, age and case number variables, as per T-Student Test (p-value < 5%) and Test F (p-value < 5%).Statistical Package SPSS was used together with a Predictive Quadratic Model to determine the average maturing time for each group. Results: The average maturing time of the group with GF, as per the Predictive Quadratic Model, was of 177 days, versus 369 days in those patients where AGF was not used that is half the time. This accelerated maturing with AGF is even more evident if one compares those patients that received ACL reconstruction with HTH graft, in both groups, attaining predictive maturing times of almost one third of the time maturing takes without GF .When we only compare those patients, in both groups, who had totally homogeneous grafts at the time of the evaluation, that is to say, scores of 0, homogenization of the graft in Group A (with GF) is achieved in 49.4% of the time it took for Group B (without GF).This is significant statistic difference. Conclusions: The remodeling process of the graft during ACL reconstructive surgery, evaluated with MR, is faster in the presence GF obtained from Platelet Derived Growth Factor The graft’s maturing time in ACL reconstruction using GF is 49.4% shorter than if not used.
INTRODUCCION
La ruptura del ligamento cruzado anterior (LCA) es una lesión frecuente de observar en medicina del deporte. La reconstrucción artroscópica de LCA ha demostrado en el tiempo mejores resultados que el tratamiento conservador y es casi de rutina en deportistas de alto rendimiento. (1)
En la última década un mejor conocimiento de la biomecánica de la rodilla, un desarrollo importante en tecnología e instrumental y nuevas formas de rehabilitación han permitido a los deportistas de alto rendimiento volver a su práctica deportiva a igual nivel de rendimiento que presentaban al momento de su lesión. (2) Hay varios factores que influyen en estos resultados como el avance experimentado en el conocimiento de las características biomecánicas de la rodilla y los elementos de fijación del injerto, cada vez más estables y seguros en el tiempo.(3) El retorno al deporte profesional es de 6 a 7 meses aproximadamente, dependiendo del tipo de deporte a practicar. En medicina del deporte ese lapso mu- chas veces es muy largo para el atleta afectado, por lo que se ha intentado buscar acciones que permitan acortar el tiempo biológico requerido, para que el injerto adquiera propiedades biomecánicas cercanas a la que tenia el ligamento cruzado original en el menor tiempo posible.
Arnoczky (4) en una publicación que es un clásico en este tema, en el año 1982, describió el comportamiento del injerto utilizado en reconstrucción de LCA en perros, señalando la presencia de tres etapas en el pro- ceso de metaplasia del injerto: Incorporación, Neoligamentización y Maduración. El tiempo estimado en es- te estudio para que este proceso ocurra es de 12 a 18 meses.(3,5,6).Varios autores trataron de estudiar el comportamiento del injerto en series clínicas, con estudios histológicos o imageneológicos que con la aparición de la resonancia magnética tuvo un importante impulso.(7,8,9,10,11,12,13,).
Nuestro equipo de trabajo, en 1995 describió como se incorporaba el injerto de tendón rotuliano utiliza- do en la reconstrucción de LCA en humanos, en un estudio clínico prospectivo, que contó con un second look artroscópico que permitió efectuar una evaluación histológica e imageneológica con Resonancia Magnética del injerto a los 6, 9 y 12 meses de evolución postoperatoria. (14)
En este trabajo pudimos determinar que el proceso de maduración del injerto hueso-tendón patelar-hueso en humanos también va cumpliendo las etapas descritas por Arnoczky aunque los plazos en que ocurren son diferentes. Observamos que a los 6 meses de evolución el injerto ya se encuentra incorporado a nivel de los túneles óseos, pero está aún en pleno proceso de metaplasia. La histología muestra células pequeñas, desordenadas y una gran proliferación de vasos. El patrón del colágeno es de baja frecuencia y existe una situación multicelular. La resonancia magnética en este periodo muestra la porción intra articular hipointensa, con edema difuso. (Fig. 1a, 1b)
A los 9 meses la resonancia magnética demuestra un injerto con hiperintensidad pero se ve con zonas corporales aun no homogéneas. La histología en esta etapa ya mostraba cambios importantes en el tipo de células, su ordenamiento y distribución era mucho mas homogénea y la vascularización menor. El colágeno tenía un patrón de alta frecuencia. Es decir histológicamente el cambio era evidente. (Fig. 1c, 1d)
A los 12 meses el aspecto del injerto a la resonancia magnética era homogéneo, hiperintenso, sin edema óseo en los túneles. La histología era similar a la que el patólogo observa en un ligamento cruzado normal, no pudiendo diferenciarla. Esto demostraba que la metaplasia del injerto estaba completa. (Fig. 1e, 1f.)
La correlación de la histología con la resonancia magnética fue de gran ayuda para poder establecer un patrón imageneológico confiable que nos permite certificar en forma no invasiva el estado de maduración del injerto de nuestros pacientes deportistas antes del reintegro al deporte sin restricciones.

Figura 1a

Figura 1b

Figura 1c

Figura 1d
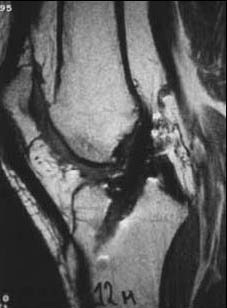
Figura 1e
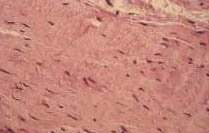
Figura F
Retorno al deporte
La posibilidad a un retorno al deporte más rápido en pacientes sometidos a reconstrucción de LCA depende de dos grandes factores:
1- Recuperación funcional de la articulación y musculatura.
2- Maduración biológica del injerto empleado.(3, 15) La evaluación Isocinética y el KT2000, son instrumentos útiles, aunque con importantes variaciones individuales, en la evaluación clínica del estado funcional de la rodilla en la recuperación posterior a la reconstrucción de LCA, pero ninguno de los dos da información acerca del comportamiento biológico del injerto que evidencie el grado de maduración. En este caso la resonancia magnética (RM), utilizando protocolos de estudio estandarizados para LCA, (9, 16, 17) como procedimiento no invasivo ha demostrado tener utilidad en determinar la integridad del injerto y la etapa del proceso de maduración en que se encuentra.
Es importante encontrar elementos que permitan acelerar el tiempo biológico de maduración del injerto para acelerar el retorno deportivo. Creemos que el empleo de factores de crecimiento puede intervenir positivamente en este proceso. (18, 19, 20, 21, 22, 23, 24, 25)
Factores de Crecimiento
Marshall R. Urist, en 1965 identificó una proteína capaz de inducir la formación de hueso, que fue llamada proteína ósea morfogenética o BMP. (26) Abrió el camino para una serie de investigaciones que arrojaron como resultado un mejor entendimiento del proceso de la reparación ósea y de los múltiples factores que intervienen en él.
En 1989, Gibble y Niss describen que el Plasma concentrado de plaquetas combinado con fibrina y calcio es capaz de formar rápidamente un gel viscoso ico en plaquetas, que mejora la incorporación de tejidos e implantes en cirugía máxilo facial. Esto abrió la puerta para investigar la presencia de factores de crecimiento que se encuentran en su gran mayoría en las plaquetas del organismo. (15,25, 27, 28, 29, 30)
Los factores de crecimiento son grupo de moléculas protéicas que no solo estimulan el crecimiento, sino que poseen otras acciones importantes como: Mantener la sobrevivencia celular; iniciar la mitogénesis y estimular la migración de las células. También producen cambios en los fenotipos que influyen en la invasión celular o la apoptosis. El concentrado plaquetario contiene una enorme cantidad de factores de crecimiento derivados de las plaquetas activadas. Estos factores están involucra- dos en la mayoría de los procesos biológicos de remodelación de nuestro organismo. En el caso puntual del injerto de LCA, el PDGF (Plattelet Derivated Growing Factor), FGF1 (Fibroblastic Growing Factor) y los distintos tipos de TGFß (Transforming Growing Factor) son los encargados de acelerar el proceso de cicatrización y aumentar la resistencia tensil del injerto. (31, 32, 33, 30, 34, 35, 36,)
Por otra parte, dentro del mismo concentrado, encontramos factores que, además de ser precursores de remodelación, otros que frenan el proceso de re- modelación. Es más, los mismos factores que en el caso del LCA son favorecedores de la remodelación, en otros tejidos pueden ser deletéreos para los objetivos de recuperación funcional, como el caso de los desgarros musculares, donde el TGF-ß es un precursor de respuesta fibroblástica con la consiguiente formación de tejido cicatricial.
Ante esta evidencia resulta válido cuestionar si el concentrado plaquetario, conteniendo una gran cantidad de factores de crecimiento, favorece el proceso de remodelación, no lo altera o por el contrario lo frena. Es decir ha abierto un importante campo de investigación al respecto.
Objetivo
Nuestro objetivo es evaluar el efecto que provoca el uso de concentrado plaquetario, obtenido de sangre autóloga a través de un proceso estandarizado, aplicado al injerto utilizado en la reconstrucción de ligamento cruzado anterior y determinar si efectivamente acelera el proceso de maduración biológica del injerto.
Para ello diseñamos un trabajo prospectivo, en el cual la única variable a estudiar fuese la utilización de factores de crecimiento obtenidos de concentra- do plaquetario antólogo, manteniendo un equipo de 3 cirujanos estable, protocolos postoperatorios y de rehabilitación únicos, y evaluación imageneológica según protocolo validado ciego simple.
En este estudio utilizamos la RM como herramienta cualitativa para determinar el momento de la maduración del injerto en pacientes sometidos a reconstrucción de LCA con concentrado plaquetario autólogo y sin concentrado plaquetario.
MATERIAL Y METODO
Se realiza en forma prospectiva el análisis de 50 re- construcciones de LCA en 50 pacientes, todas ellas realizadas por el mismo equipo quirúrgico. Se incluyeron reconstrucciones de LCA con autoinjerto de hueso-tendón hueso y semitendinoso gráciles en forma aleatoria con el objetivo de obtener 2 grupos: A y B.
Al grupo A, además efectuar la reconstrucción de LCA, se adiciona Concentrado Plaquetario Autólogo, desarrollando una técnica de aplicación que per- mite estandarizar la dosis de concentrado empleada y evitar la pérdida de este en el paso del injerto a través de los túneles óseos.
El concentrado plaquetario autólogo, se obtuvo a través del sistema GPS™ de BIOMET Inc. Este procedimiento se lleva a cabo dentro del mismo pabellón, con técnica aséptica. Se extraen 60 cc de sangre autóloga dentro de la inducción anestésica, los que son centrifugados por 15 minutos. Con ello se obtiene una división de la sangre en tres fases. Se extrae aquella fase que contiene el concentrado plaquetario, obteniendo un volumen entre 6 y 10 cc. Posteriormente se extraen otros 10 cc de sangre que se centrifugan por 5 minutos, con el objeto de obtener aproximadamente 1 a 2 cc de plasma que contiene trombina. En mesa de instrumentista se monta en 2 jeringas: una de 10 cc. con concentrado plaquetario y otra de 1 cc. con trombina. Ambas jeringas se unen a través de una aguja de doble lumen en forma de Y, lo que permite realizar la mezcla en forma exacta de ambos contenidos en forma simultanea, lográndose la activación del concentrado plaquetario al momento de aplicarlo sobre el injerto. En el caso del injerto del HTH, después de pulir los tarugos óseos y calibrarlos para que pasen por el túnel, el segmento óseo femoral y el segmento intraarticular son forrados en una gelita bioabsorvible sintética denominada GELFOAM (Pfizer) sobre el injerto y suturado a este con vycril 3-0.
En el caso de STG, estos se preparan de manera habitual, extrayendo tejido muscular remante.
En cada uno de sus extremos se hace un trenzado de aproximadamente 3 cms con FIBERWIRE (Arthrex, Naples, FL) y mide el grosor y largo del tendón. Bajo tensión moderada se procede a colocar entre la porción de los tendones que se van a ubicar en el túnel femoral y segmento intraarticular, un trozo de GELFOAM. Este se sutura al tendón adyacente con vycril 3-0.
Esta gelita actúa como una esponja que mantiene la dosis de concentrado plaquetario en contacto directo con el injerto utilizado. (Fig 2)
Se adiciona en forma homogénea un volumen total de 5 cc de plasma rico en plaquetas activadas al momento de la inoculación sobre el injerto y espera que a se forme un coagulo. El coágulo formado queda adherido al injerto, gracias a la presencia de la gelita suturada y comprimida. Esto permite aportar una cantidad precisa de factores de crecimiento y lo que es más importante, se evita la pérdida del coágulo en al paso del injerto por los túneles óseos. (Fig. 3 a, 3 b, 3 c)

Figura 2

Figura 3a

Figura 3b
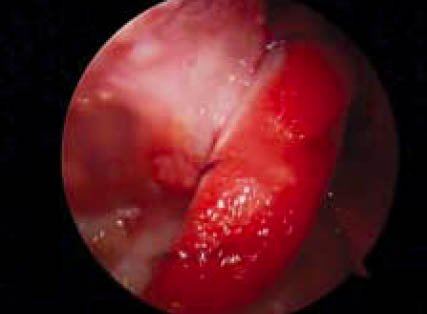
Figura 3c
Los injertos son fijados a hueso adyacente con tornillos interferenciales metálicos, en el caso de injerto HTH y con técnica TRANFIX (Arthrex, Naples, FL) metálico en fémur distal y tornillo bioabsorvible tipo Delta (Arthrex, Naples, FL) más grapa metálica en tibia proximal en el caso de injerto de STG.
Todos los pacientes siguen un período de rehabilitación kinésica según protocolos acelerados para cirugía de LCA.
Se protocolizó una serie de imágenes dirigido solo al estudio del segmento intraarticular del injerto, estandarizado y común para ambos grupos. Este se realizó en una secuencia en T2 (TR 4020, TE 105) con un resonador de Siemens Magnetom de 1,5 T (Siemens AG, Erlangen, Alemania). Se efectuaron cortes de 2 mm. de espesor, parasagitales oblicuos, entre 10 y 15°, centrados en la zona intercondílea, con la rodilla flectada en 90°, técnica validada por A. Weiler. (41) Los pacientes del grupo A se sometieron a estudio de resonancia magnética en forma seriada a los 3, 4, 5, 6, 7, 8 y 9 meses postoperatorio. El grupo control el estudio se realizó a los, 6, 7, 8, 9,10 ,11 ,12 meses.
La evaluación de las placas obtenidas fue realizada por un solo radiólogo experimentado en estudio músculo esquelético, en forma ciega, ya que desconocía: tiempo de evolución, técnica quirúrgica empleada o si se aplicó AGF al injerto.
El radiólogo dividió el segmento intraarticular del injerto en tres porciones: proximal, media y distal. A cada porción le asignó un puntaje de acuerdo al grado de heterogenicidad observado. Es así como a
un segmento absolutamente homogéneo se le adjudicó un puntaje igual a cero, levemente heterogéneo de uno, moderadamente heterogéneo de dos y con heterogenicidad severa igual a tres (Tabla 1).

Tabla N°1. Evaluación imageneológica del segmento intraarticular del injerto, dividido en tres porciones: proximal, media y distal. Asignándose un puntaje de acuerdo al grado de heterogenicidad observado.
En cada paciente se obtuvo una sumatoria de los puntajes de cada segmento, el que fue comparado estadísticamente entre los dos grupos y correlacionado con el tiempo en que se realizó el estudio con RM. (Fig. 4 a, 4b,)
Análisis estadístico
Para el análisis estadístico se trabajó con tablas de datos que se introdujeron al programa SPSS. En él se trabajó con cuadros estadísticos, gráficos, datos e indicadores descriptivos.
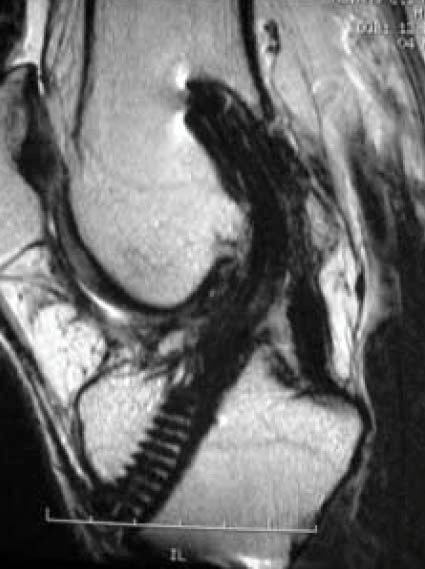
Figura 4a

Figura 4b
Para determinar si ambos grupos eran comparables en número, edad y sexo se utilizó la prueba F y la de T-Student.
El tiempo de maduración del injerto, es decir, el tiempo predictivo de homogenización de los cortes de RM se obtuvo a través de un Modelo Cuadrático Predictivo, utilizando el tiempo en que se realizó la RM, correlacionado con el puntaje total del segmento intraarticular.
RESULTADOS
Ambos grupos de 25 paciente cada uno, quedaron constituidos de la siguiente manera: Grupo A: con Factores de crecimiento (AGF). Dicieocho hombres y 7 mujeres, con una mediana de edad de 30 años. Injerto utilizado:15 Semitendinoso-Gráciles / 10 HTH. Grupo B: control; sin Factores de crecimiento (AGF).Veintiún hombres y 4 mujeres, con una mediana de edad de 32 años.
Injerto utilizado: 10 Semitendinoso-Gráciles / 15 HTH.
El puntaje promedio de maduración al momento de la resonancia magnética, entregado por el radiólogo en el grupo A fue de 1,14 y en el grupo B (control) fue de 3,25.
Ambos grupos son comparables según sexo y edad (p-value < 5%). (Fig. 4-a; 4-b)
El tiempo de maduración del segmento intraarticular, en el grupo A (con adición de AGF) alcanzó los
177 días posterior a la cirugía.
En el grupo B (control) fue de 369 días.
Esto determina que el tiempo de maduración, utilizan- do el Modelo Cuadrático Predictivo, es de práctica- mente la mitad en el caso de injertos a los cuales se les aplico factores de crecimiento (AGF). (Gráfico Nº 1).
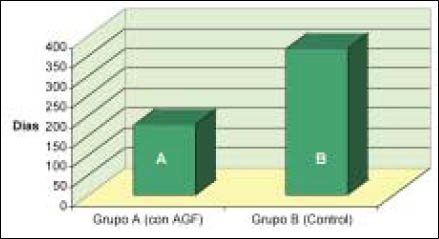
Gráfico Nº 1: Maduración del injerto, utilizando el modelo cuadrático predictivo del Grupo A: con AGF vs. Grupo B: control.
Este hecho es aún más evidente al comparar solo los casos de injerto con HTH de ambos grupos, donde el tiempo de maduración en pacientes con AGF es de 109 días, versus 363 días en el grupo control, es decir, se alcanza la maduración en prácticamente un tercio del tiempo que en el grupo control (Gráfico Nº 2)
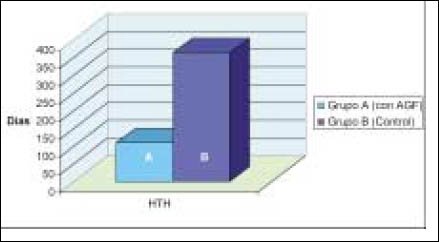
Gráfico N°2: Maduración del injerto Hueso-Tendón Patelar-Hueso, comparando Grupo A: con AGF vs. Grupo B: control.
Este último punto, a pesar de la gran diferencia entre ambos grupos, marca solo una tendencia estadística porque carece de poder significativo.
Por otro parte, analizamos solo a aquellos pacientes con injertos con puntaje igual a 0 al momento de la evaluación con RM (12 del grupo con AGF y 6 del grupo control), es decir, injertos completamente homogéneos y por ende maduros. En ellos se compararon los tiempos en que fueron obtenidas las imágenes de RM, se determina que en el grupo con AGF el tiempo promedio de días para obtener injertos maduros fue de 179 días y en el grupo control de 360 días (Gráfico 3). Esto determina injertos maduros, en el caso de pacientes con AGF, en la mitad del tiempo (49,4%) que injertos sin AGF (p-value 0,000).

Gráfico N°3: Comparación de solo injertos maduros de Grupo A: con AGF vs. Grupo B: control
Nuevamente, modificando el análisis de los datos, se obtiene que el tiempo de homogenización del segmento intra-articular del injerto de LCA evaluado con cortes específicos de RM es la mitad del tiempo que si no se emplean Factores de Crecimiento, obtenidos a través de una técnica estandarizada de Concentrado Plaquetario Autólogo .
DISCUSION
Para el deportista de alto rendimiento, sufrir una ruptura de su ligamento cruzado anterior de su rodilla es sin duda un evento traumático y clave en su vida deportiva. La recuperación de esta lesión debe ser lo más cercana a lo normal para no afectar su rendimiento deportivo futuro y en el menor tiempo posible. (32, 37)
Durante la última década hemos tenido grandes avances en la reconstrucción quirúrgica del LCA, mejorando notoriamente sus resultados. Esto gracias al desarrollo de técnicas más anatómicas de reconstrucción, elementos de fijación más firmes y estables en el tiempo (38), protocolos de rehabilitación acelerado y equipos quirúrgicos técnicamente mejor preparados y competentes.
Sin embargo, las re-roturas en estos deportistas, atribuidos a traumas en periodos de reintegro deportivo precoz, nos indican claramente que el periodo biológico de maduración y metaplasia que debe tener el injerto utilizado en la reconstrucción, no se afecta o altera con los avances ya descritos. Ese periodo es en promedio para el injerto de tendón patelar de 9 a 12 meses. (2, 11, 14)
Por ello el avance en ciencias básicas, en relación al estudio de los factores de crecimiento, sus funciones y capacidad de reparación, aceleración y desarrollo de tejidos ha sido el centro de los investigadores en los últimos años. Yasuda (43), analizando el efecto de los factores de crecimiento aplicados al injerto en modelos caninos, señala que el TGF-b y EGF actúan aumentando la síntesis de colágeno y fibroblastos en el injerto en un 40%. Kyle Anderson (2), el mismo año señala que la presencia de factores de crecimiento TGF-b1,TGF-b2 TGF-b3 y TGF-1 influyen directamente en el injerto mejorando la velocidad de cicatrización y aumentando la resistencia a la fuerza tensil en un 65%.
En otro interesante estudio experimental, Weiler (34) señala que la aplicación de factores de crecimiento obtenidos de Concentrado plaquetario autólogo y aplicados al injerto al momento de la cirugía, eran capaces de alterar la evolución natural de este, mejorando la fuerza tensil y resistencia, aumentado la velocidad de maduración y calidad del colágeno.
Basado en esta sólida evidencia científica (32, 37, 38, 39, 40), nuestro equipo de trabajo decidió evaluar qué ocurría con el comportamiento biológico del injerto en la reconstrucción de LCA si se le agregaba al momento de la cirugía una cantidad de 5 cc. de concentrado plaquetario autólogo, rico en facto- res de crecimiento.
Nuestro laboratorio clínico analizó el número de plaquetas que se obtenía con el centrifugado en pabellón de 50 cc de sangre del paciente y el estado de las pla- quetas (activas o inactivas) después de este procedimiento. Pudimos constatar que el concentrado plaquetario obtenido contenía en promedio 5 veces más plaquetas no activadas que su concentración plasmática basal. Este método aunque es de alto costo, es seguro y fácil de implementar en los quirófanos. Definimos un protocolo estudio imageneológico basado en la propuesta de A. Weiler, (17) que permite visualizar en forma más completa y exacta el LCA o en su defecto el injerto.
Diseñamos un trabajo prospectivo, que tuviera un nivel de medicina basada en la evidencia de 2. Los pacientes evaluados en forma prospectiva, fueron tratados por el mismo equipo quirúrgico y el mismo protocolo de rehabilitación. La idea era que entre los dos grupos estudiados existiera solo una variable única: la presencia de factores de crecimiento obtenidos de un concentrado plaquetario autólogo.
El desafío fue el diseñar una técnica de aplicación de los factores de crecimiento al injerto, que nos asegurara su permanencia en este luego del paso del injerto por los túneles óseos y su dosificación estandarizada. Lo obtuvimos con el empleo de la gelita gelfoam de pfizer y los detalles técnicos los publicamos en revistas y videos para su revisión. (4,42) Los resultados, bastante sorprendentes nos señalan que se acortan en forma significativa el tiempo de maduración biológica del injerto, en al menos un 49%. Esto significa que el injerto utilizado podría tener su proceso completo el la mitad del tiempo requerido en forma natural. Gran noticia ya que un deportista profesional podría retornar al deporte entre el 4 y 5 mes. Estamos realizando un seguimiento a todos nuestros deportistas operados para ver qué ocurre en el tema de re-roturas, pero los plazos son aún breves. El uso de la gelita del laboratorio Pfizer (Gelfoam) podría afectar la visión o análisis de la Resonancia Magnética, pero al ser un elemento absorbible, al momento de la evaluación imageneológica ,ya puede estar biodegradada.
Para nuestros pacientes, la mayoría deportistas de alto rendimiento, la posibilidad de reducir el tiempo de maduración biológica del injerto les ha permitido trabajar con más motivación y seguridad en su rehabilitación funcional y por ende retornar al deporte en promedio dos meses antes que en el periodo anterior.
Aunque no tiene directa relación con este trabajo, creo importante señalar que para autorizar el reintegro deportivo sin restricciones, se requiere que el deportista recupere íntegramente su atrofia muscular, no tenga desbalance entre extensores y flexores de su rodilla y alcance una adecuada condición física. Esto se evalúa en forma objetiva con análisis isocinético, pruebas de saltabilidad y consumo de oxígeno.
Debe trabajar en cancha propiocepción y gestos deportivos específicos .La resonancia magnética debe demostrar integración del injerto y signos de maduración total, basados en la tabla de evolución ya descrita.
Sin duda, aún queda mucho camino por recorrer. La aplicación actual de los factores de crecimiento obtenidos de concentrado plaquetario autólogo, (30, 37, 38, 41) no nos permite aislar en forma específica a aquellos que tienen que ver con el proceso . Seguramente estamos aplicando un cóctel de factores que al parecer no participan ni influyen en la cicatrización de estos tejidos.(32,43,44). Tampoco tenemos claro si una aplicación aislada al momento de la cirugía es suficiente o si sería aun más efectivo repetir la aplicación de estos factores durante el proceso de recuperación y rehabilitación postoperatoria.
¿Cuales son los factores de crecimiento que realmente se necesitan en reconstrucción de LCA? ¿La cantidad que estamos aplicando es la adecuada? ¿Es importante mantener la interacción y equilibrios entre todos los factores de crecimiento presentes en el concentrado plaquetario? ¿Cuánto tiempo dura su efecto?
Las respuestas a estas interrogantes aún no la tenemos, pero sin duda representaran otro gran avance en el tratamiento de estas lesiones deportivas en el futuro.
BIBLIOGRAFIA
- Amiel D, Kleiner JB, Akeson WH. The natural history of the anterior cruciate ligament autograft of patellar tendon origin. Am J Sports Med. 1986;14:449-462.
- Howell SM, Knox KE, Farley TE, et al: Revascularization of a human anterior cruciate ligament graft during the first two years of implantation. Am J Sports Med. 1995;23:42–9.
- 3. Johnson LL. The outcome of a free autogenous semitendinosus tendon graft in human anterior cruciate reconstructive surgery: A histological study. Arthroscopy. 1993;9:131-142.
- 4. Arnoczky SP, Tarvin GB, Marshall JL. Anterior cruciate ligament replacement using patellar tendon: an evaluation of graft revascularization in the dog. J Bone Joint Surg Am. 1982;64:217-224.
- 5. Falconiero RP, DiStefano VJ, Cook TM. Revascularization and ligamentization of autogenous anterior cruciate ligament grafts in humans. Arthroscopy. 1998;14:197-205.
- 6. Kleiner JB, Amiel D, Harwood FL, Akeson WH. Early histologic, metabolic, and vascular assessment of anterior cruciate ligament autografts. J Orthop Res. 1989;7:235-242.
- 7. Abe S, Kurosaka M, Iguchi T, Yoshiya S, Hirohata K. Light and electron microscopic study of remodeling and maturation process in autogenous graft for anterior cruciate ligament reconstruction. Arthroscopy. 1993; 9:394-405
- 8. Gallimore GW Jr, Harms SE: Knee injuries: High-resolution MR imaging. Radiology.1986;160:457-61.
- 9. Grøntvedt T, Engebretsen L, Rossvoll I, et al. Comparison between magnetic resonance imaging findings and knee stability: Measurements after anterior cruciate liga- ment repair with and without augmentation: A five- to seven-year followup of 52 patients. Am J Sports Med. 1996; 23:729–35.
- 10. Howell SM, Clark JA, Blasier RD. Serial magnetic reso- nance imaging of hamstring anterior cruciate ligament autografts during the first year of implantation. A preliminary study. Am J Sports Med. 1991;19:42-7.
- 11. Maywood RM, Murphy BJ, Uribe JW, et al. Evaluation of arthroscopic anterior cruciate ligament reconstruction using magnetic resonance imaging. Am J Sports Med. 1993;21:523-7.
- 12. Rougraff BT, Shelbourne KD. Early histologic appearance of human patellar tendon autografts used for anterior cruciate ligament reconstruction. Knee Surg Sports Traumatol Arthrosc.1999;7:9-14.
- 13. Rougraff B, Shelbourne KD, Gerth PK, Warner J. Arthroscopic and histologic analysis of human patellar tendon autografts used for anterior cruciate ligament reconstruction. Am J Sports Med. 1993;21:277-84.
- 14. Radice, F; Gutiérrez V; Ibarra, A; Verdugo MA; Arthroscopic, Histologic and MRI Correlation in the maturation process of the grafo in ACL Reconstruction in Humans. Arthroscopy. 1998; 14, N°2, Suppl 1: S 20.
- 15. Hildebrand KA, Woo SL-Y, Smith DW, et al. The effects of platelet-derived growth factor-BB on healing of the rabbit medial collateral ligament. Am J Sports Med. 1998;26:549-554.
- 16. Rak KM, Gillogly SD, Schaefer RA, et al. Anterior cruciate ligament reconstruction: Evaluation with MR imaging. Radiology.1991;178: 553–6.
- 17. Weiler A, et al. Biomechanical properties and vascularity of an anterior cruciate ligament graft can be predicted by contrast-enhanced magnetic resonance imaging: A two- year study in sheep. Am J Sports Med. 2001;29:751-61.
- 18. Anderson, Kyle; Aruna M. Seneviratne,et al. Augmentation of Tendon Healing in an Intraarticular Bone Tunnel with Use of a Bone Growth Factor . Am. J. Sports Med., Nov 2001; 29: 689 – 698.
- 19. DesRosiers EA, Yahia L, Rivard CH. Proliferative and matrix synthesis response of canine anterior cruciate ligament fibroblasts submitted to combined growth factors. J Orthop Res. 1996;14:200-208.
- 20. Jenner JM, Van Eijk F, et al. Effect of Transforming Growth Factor-Beta and Growth Differentiation Factor-5 on proliferation and matriz production by human bone marrow stromal cells cultured on braided poly lactic-co- glycolic acid scaffolds for ligament tissue engineering. Tissue Eng. 2007;13:1573-82.
- 21. Kondo E, Yasuda K, et al. Effects of administration of exogenous growth factors on biomechanical properties of the elongation-type anterior cruciate ligament injury with partial laceration. Am J Sports Med. 2005;33:188-96.
- 22. Lee J, Green MH, Amiel D. Synergistic effect of growth factors on cell outgrowth from explants of rabbit anterior cruciate and medial collateral ligaments. J Orthop Res. 1995;13:435-441.
- 23. Letson AK, Dahners LE. The effect of combinations of growth factors on ligament healing. Clin Orthop. 1994;308:207-212.
- 24. Marui T, Niyibizi C, Georgescu HI, et al. Effects of growth factors on matrix synthesis by ligament fibro- blasts. J Orthop Res. 1997;15:18-23.
- 25. Murray MM, Spindler KP, et al. Collagen-platelet rich plasma hydrogel enhances primary repair of the porcine anterior cruciate ligament. J Orthop Res. 2007;25(1):81-91.
- 26. Urist Marshall R. et al. Bone Formation by Auto Induction. Science, v. 150, p. 893-97, 1965.
- 27. Pierce GF, Mustoe TA, Lingelbach J, et al. Platelet-derived growth factor and transforming growth factor–ß enhance tissue repair activities by unique mechanisms. J Cell Biol. 2000;109:429-440.
- 28. Sanchez M, Azofra J, Anitua E, Andía I, Padilla S, Mujika I. Enhanced Achilles tendón healing with autologous plasma rich in growth factors. Br J Sports Med.2003.
- 29. Sánchez M, Azofra J, Aizpurua B, Elorriaga R, Anitua E, Andia I. Aplicación de plasma autólogo rico en factores de crecimiento en cirugía artroscópica. Cuadernos de Artroscopia (Asociación Española de Artroscopía). 2003;10,19.
- 30. Schmidt CC, Georgescu HI, Kwoh CK, et al. Effect of growth factors on the proliferation of fibroblasts from the medial collateral and anterior cruciate ligaments. J Orthop Res. 1995;13:184-190.
- 31. Azuma H, Yasuda K, Tohyama H, et al. Timing of administration of transforming growth factor–beta and epidermal growth factor influences the effect on material properties of the in situ frozen-thawed anterior cruciate ligament. J Biomech. 2003;36:373-381.
- 32. Fu FH, Musahl V. The Treatment of Focal Articular Cartilage Lesions of the Knee Future Trends and Technologies . Sports Med Arthro 2003;11:202–212
- 33. Sakai T, Yasuda K, Tohyama H, et al. Effects of combined administration of transforming growth factor-beta 1 and epidermal growth factor on properties of the in situ frozen anterior cruciate ligament in rabbits. J Orthop Res. 2002;20:1345-51.
- 34. Weiler A, et al. The influence of locally applied Plate- let-Derived Growth Factor–BB on free tendon graft remodeling after anterior cruciate ligament reconstruction. Am J Sports Med. 2004;32:881-91.
- 35. Yasuda K, Tomita F, et al. The effect of Growth Factors on biomechanical properties of the bone–patellar tendon–bone graft after anterior cruciate ligament reconstruction: A canine model study. Am. J. Sports Med. 2004;32:870-80.
- 36. Yamazaki S, Yasuda K, et al. The effect of Transforming Growth Factor- 1 on intraosseous healing of flexor tendon autograft replacement of anterior cruciate ligament in dogs. Arthroscopy. 2005;21:1034-41.
- 37. Steiner, M. E., Murray, M. M; and S. A. Rodeo. Strategies to Improve Anterior Cruciate Ligament Healing and Graft Placement. Am. J. Sports Med., January 1, 2008;36(1): 176-189.
- 38. Tohyama H, Yasuda K. Extrinsic cell infiltration and re- vascularization accelerate mechanical deterioration of the patellar tendon after fibroblast necrosis. J Biomech Eng. 2000;122:594-599.
- 39. Unterhauser FN, Weiler A, et al. Endoligamentous revascularization of an anterior cruciate ligament graft. Clin Orthop Relat Res. 2003;414:276-88.
- 40. Yoshikawa T, Tohyama H, Enomoto H, et al. Temporal changes in relationships between fibroblast repopulation, VEGF expression, and angiogenesis in the patellar ten- don graft after anterior cruciate ligament reconstruction. Trans Orthop Res Soc. 2003;29:236.
- 41. Radice, F; Yañez, R; Gutiérrez V; Pinedo ,M.: Aplicación de factores de crecimiento obtenidos de concentrado plaquetario en la reconstrucción de LCA. Consejos prácticos para cuantificar su dosis y evitar su pérdida al pasar por los túneles óseos. NotiSlard 2007;Vol 2, 7-8. ( www.slard.org)
- 42. Radice,F..: Preparación del injerto en reconstrucción de LCA aplicando factores de crecimiento obtenidos de concentrado plaquetario. Videoteca www.socht.cl Video 10.;Nov 2005.
- 43. Ju YJ, Tohyama H, Kondo E, et al. Effects of local administration of vascular endothelial growth factor on properties of the in situ frozenthawed anterior cruciate ligament in rabbits. Am J Sports Med. 2006;34:84-91.
- 44. Yoshikawa T, Tohyama H, Katsura T, Kondo E, Yasuda K,et al. Effects of local administration of Vascular En- dothelial Growth Factor on mechanical characteristics of the semitendinosus tendon graft after anterior cruciate ligament reconstruction in sheep. Am J Sports Med 2006;36:1918-25.
Dr. Fernando Radice D.
Email: Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
* Departamento de Ortopedia y Traumatología, Clínica
Las Condes. www.clc.cl
Santiago-Chile.
